DEFINISINYA !
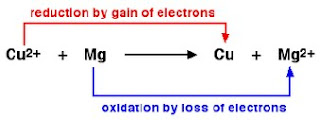
Oksidasi :
- pelepasan elektron ( dalam reaksi elektron berada di ruas kanan )
- menangkap oksigen
- melepas Hidrogen
- Bilangan Oksidasi (Biloks)nya bertambah
Reduksi :
- penangkapan elektron (dalam reaksi elektron berada di ruas kiri )
- melepas oksigen
- menangkap Hidrogen
- Bilangan Oksidasi (Biloks)nya berkurang
Reaksi redoks adalah reaksi yang mengalami dua peristiwa yaitu reduksi dan oksidasi (ada perubahan Biloks satu atau lebih unsur yang bereaksi).
Reaksi autoredoks adalah reaksi redoks yang hanya satu jenis unsur yang mengalami reduksi dan oksidasi.
Untuk menentukan reaksi redoks (reduksi-oksidasi) tidak selalu menghitung nilai biloksnya karena kadang2 dapat ditentukan dengan cepat, sebagai contoh :
penentuan reaksi redoks di atas berdasarkan penerimaan/pelepasan oksigen
penentu reaksi redoks di atas berdasarkan penerimaan /pelepasan Hidrogen
penentuan reaksi redoks di atas berdasarkan penerimaan/pelepasan elektron.
Dalam reaksi redoks juga dikenal istilah reduktor dan oksidator :
Reduktor zat yang mengalami oksidasi (Biloks naik)
Oksidator zat yang mengalami reduksi (Biloks turun)
PATOKAN penentuan Bilangan Oksidasi (Biloks)
- Biloks atom dalam unsur tunggal = 0 . Contoh Biloks Cu, Fe, H2, O2 dll = 0
- Golongan IA ( Li, Na, K, Rb, Cs dan Fr ) biloksnya selalu +1
- Golongan IIA ( Be, Mg, Ca, Sr dan Ba ) biloksnya selalu +2
- Biloks H dalam senyawa = +1, Contoh H2O, kecuali dalam senyawa hidrida Logam (Hidrogen yang berikatan dengan golongan IA atau IIA) Biloks H = -1, misalnya: NaH, CaH2 dll
- Biloks O dalam senyawa = -2, Contoh H2O, kecuali OF2 biloksnya = + 2 dan pada senyawa peroksida (H2O2, Na2O2, BaO2) biloksnya = -1 serta dalam senyawa superoksida, misal KO2 biloksnya = -1/2. untuk mempermudah tanpa banyak hafalan....bila atom O atau H berikatan dengan Logam IA atau IIA maka biloks logamnyalah yang ditentukan terlebih dahulu dan biloks O dan H nya yang menyesuaikan (besarnya dapat berubah - ubah)
- total Biloks dalam senyawa tidak bermuatan = 0, Contoh HNO3 : (Biloks H) + (Biloks N) + (3.Biloks O) = 0 maka dengan mengisi biloks H = +1 dan O = -2 diperoleh biloks N = +5
- Total BO dalam ion = muatan ion, Contoh SO4 2- = (Biloks S) + (4.Biloks O) = -2 maka dengan mengisi biloks O = -2 diperoleh biloks S = +6
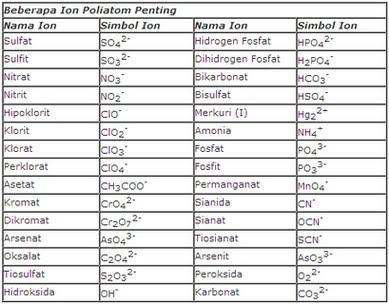
selain hafalan di atas kita juga sebaiknya menghafal beberapa ion Poliatom yang sering keluar dalam soal sebab hafalan ion Poliatom tersebut juga diperlukan dalam menentukan harga biloks.
Tabel Ion Poliatom yang Penting :
misal : biloks Cu dalam CuSO4 dapat dihitung dengan (1 x biloks Cu) + (1 x biloks total ion SO4) = 0 maka dengan mengisi biloks ion SO4 = -2 diperoleh :
biloks Cu + (-2) = 0 ---> sehingga biloks Cu = +2
Contoh lainnya.... untuk menentukan biloks P dan Fe dalam Fe3(PO4)2 kita harus bentuk anion poliatomnya, yakni PO43- sehingga :
(1 x biloks P) + (4 x biloks O) = -3
(1 x biloks P) + (4 x biloks O) = -3
biloks P + (-8) = -3 sehingga biloks P = + 5
kemudian biloks Fe dapat dicari dengan :
(3 x biloks Fe) + (2 x muatan PO4) = 0
(3 x biloks Fe) + (-6) = 0
3 x biloks Fe = + 6 ---> sehingga biloks Fe = + 6/3 = +2
namun untuk mencari biloks salah satu unsur saja.....sedangkan biloks unsur2 yang lainnya sudah diketahui (ada hafalannya) maka biloks unsur tersebut dapat ditentukan secara langsung tanpa harus menghafal muatan ion poliatomnya :
misalnya : Tentukan biloks Cr dalam H2Cr2O7...?
(2 x biloks H) + (2 x biloks Cr) + (7 x biloks 7) = 0
(2 x (+ 1)) + (2 x biloks Cr) + (7 x (-2)) = 0
(2 x biloks Cr) + (-12) = 0 ---> sehingga biloks Cr = +12/2 = +6





























0 comment:
Posting Komentar